La materia es todo lo que ocupa un espacio, que posee una cantidad de energía y que perdura en el tiempo. En otras palabras, materia es todo lo que ocupa un lugar en el espacio que se puede tocar, sentir, medir, etc.
Todos los objetos que observamos están formados por materia. La materia se define como todo aquello que tienen masa, y ocupa un lugar en el espacio. Ademas del volumen y la masa, la materia presenta otras propiedades como:
- Densidad
- Brillo
- Color
- Sabor
- Olor
- Textura.
PROPIEDADES GENERALES
Son aquellas que poseen todos los materiales, son comunes a todo tipo de materia, pueden tener cualquier valor independiente de la clase de material de este objeto.
La materia tiene dos clases de propiedades: Propiedades generales Propiedades características Las tienen todos los cuerpos sin distinción y por tal motivo no permiten diferenciar una sustancia de otra. Su valor depende de la cantidad de materia: masa, peso, volumen, energía, porosidad y elasticidad, entre otras Son aquellas que no dependen de la cantidad de sustancia o del tamaño de un cuerpo. Ejemplos de estas propiedades son: temperatura, punto de ebullición, punto de fusión, densidad, color, sabor, etc., en general, todas aquellas que caracterizan a una sustancia diferenciándola de otras.
PROPIEDADES ESPECÍFICAS
Son propias de cada material y permiten caracterizarlo, identificarlo y diferenciarlo de otros. Estas propiedades pueden ser físicas y químicas.
PROPIEDADES FÍSICAS
Determinan sin que cambien la composición de un material. Entre estas propiedades se encuentran el estado físico, la densidad, el punto de ebullición, el punto de fusión y la solubilidad.
EL ESTADO FÍSICO
Es importante porque nos posibilita describir y clasificar los materiales. Los objetos que a diario manipulamos hay materiales en estado sólido, líquido y gaseoso.

PROPIEDADES QUÍMICAS
Determinan los cambios en la composición y estructura de los materiales. Permiten conocer la interacción de los materiales con el medio.
EJEMPLO:
- La electricidad
- El calor
- El agua
- El aire
Cambios de la Materia
Los cambios de la materia pueden ser físicos o químicos. Afectan su forma, tamaño o estado de agregación son considerados cambios físicos.
Cambios físicos.
La materia cambia su apariencia, pero no se altera su composición.
disolver azúcar o sal en agua, la formación de hielo y la evaporación de un liquido son ejemplos de cambio físico.
EJEMPLOS:
- Los materiales modifican su apariencia y la forma pero no se produce cambio en la estructura ni en la composición del material.
- El agua es la misma no importa el estado en el que se encuentre.
Cuando los cambios físicos hay influencia del calor, hablamos de cambios progresivos y regresivos. Ocurren cuando la materia pasa de un estado de mayor agregación a uno de menor agregación solido a liquido, liquido a gas, o solido directamente a gas.
Cambios de Estado
Son variaciones físicas reversibles. Estos se producen por cambios en la energía calórica y por variación de la presiona. Los cambios de estado son evaporación, fusión, condensación, solidificación, sublimación.
Vaporización
Es el proceso en el que un liquido pasa a estado gaseoso. La evaporación es el fenómeno que ocurre cuando dejamos destapado un frasco de perfume; al cabo de un tiempo, parte del volumen del liquido se ha evaporado.
Condensación
Cuando el estado gaseoso se pasa a estado liquido, y en este proceso el gas cede calor al entorno. la formación de las nubes es un ejemplo de condensación.
Fusión
Se aumenta la temperatura a un solido las moléculas ganan energía y cambia de estado. Al aplicar calor a una tira del metal magnesio, este se derrite.
Solidificación
Cambio de estado de un liquido a un solido debido a la liberación de calor. Proceso es evidente en la formación del hielo.
Sublimación
Proceso el cual es una sustancia solida se traspasa directamente al estado de vapor sin pasar por el estado liquido.
Cuando el transcurso es directamente de gas a solido se llama sublimación regresiva o deposición.
Cambios Químicos
Cuando quemamos un trozo de papel, encendemos una vela o cocinamos los alimentos ocurren cambios químicos.
Al quemar papel no solo se modifica de forma y estado, sino que su estructura y composición dejan de ser las mismas.
Los cambios químicos se producen reacciones químicas. Estas se dan cuando dos o mas sustancias reaccionan para dar lugar a sustancias diferentes.
EVOLUCIÓN E HISTORIA DE LAS TEORÍAS SOBRE LA CONSTITUCIÓN DE LA MATERIA.
LOS ESPECTROS ATÓMICOS
Poseen espectros que corresponden al registro de las radiaciones absorbidas o emitidas por los átomos que los constituyen.
Los espectros de emisión indican que un electrón en el átomo sólo puede tener determinadas energías.
El espectro de absorción consiste en los haces de luz que no son absorbidos.Cada elemento tiene un espectro propio, el cual es como la huella dactilar del mismo, para medirlos se utiliza el espectroscopio.
EL MODELO ATÓMICO ACTUAL
Se observó que las líneas en los espectros se dividían en rayas más pequeñas que implicaban estados intermedios de energía entre los niveles propuestos por Bohr.
En 1924, De Broglie propuso la naturaleza dual del electrón, esto involucra que el electrón, además de poseer masa y viajar a velocidades cercanas a la de la luz, presentara un comportamiento ondulatorio que no podía ser explicado desde la física clásica.
En 1926, Heisenberg establece que no es posible determinar la posición y velocidad de una partícula como el electrón al mismo tiempo. A diferencia del modelo de Bohr, la solución de esta ecuación no indica la posición del electrón en términos de órbitas, sino suministra información sobre la probabilidad de encontrar el electrón en una región del espacio, a la cual se le da el nombre de orbital.
EL ÁTOMO
Se compone de un núcleo central en donde se concentra prácticamente toda la masa atómica y periferia. El núcleo está ocupado por dos clases de partículas fundamentales: los protones y los neutrones.
Los protones son partículas cargadas positivamente y poseen una masa característicamente. Los neutrones no tienen carga y presentan una masa también particular que tienen casi el mismo valor que la masa del protón.
El número de protones del núcleo atómico de un elemento químico se llama número atómico y se representa con la letra Z.
EJEMPLO:
Todos los átomos de oxígeno tienen 8 protones en su núcleo (Z=8), sodio tiene once protones en su núcleo (Z=11).
La suma de los protones y los neutrones del núcleo atómico de un elemento químico se denomina número másico o masa atómica del elemento y se simboliza con la letra A.
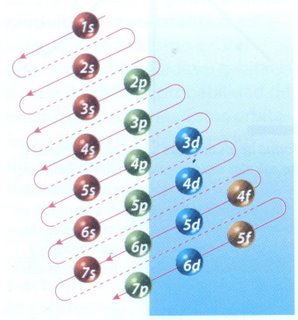
LA CONFIGURACIÓN ELECTRÓNICA DEL ÁTOMO
Los electrones se distribuyen en niveles de identificadas con las letras °K a la Q porque hay 7 niveles. De acuerdo con el número de electrones del átomo, se ubican 2 en el primer nivel (K), hasta 8 en el nivel (L), y en las otras varía.
Un átomo con 3 electrones, tendrá 2 en el nivel 1s y 1 en el nivel 2s. Un átomo con 5 electrones tendrá la siguiente configuración: 2 en la 1s, 2 en la 1s, 2 en la 2s y 1 en la 2p.
La configuración del sodio, Z=11, la configuración sería:2 en 1s, 2 en 2s, 6 en 2p y 1 en 4s. Se lo representaría en la siguiente forma: 1s2,2s2,2p6,3s1, la configuración del cloro, Z=17.
LA TABLA PERIÓDICA Y LOS ELEMENTOS QUÍMICOS.
Jöns Jakob Berzelius fue el primero en surgir los símbolos de los elementos químicos utilizando la primera letra del nombre del elemento en latín o en griego en mayúscula.
EJEMPLO:
flúor (F).
Debido a diversos elementos que se conocían y para evitar confusiones, se acordó emplear las dos primeras letras del nombre.
EJEMPLO:
Sodio (Na, en latín:natrium).
EJEMPLO:
Sodio (Na, en latín:natrium).
LA TABLA PERIÓDICA DE LOS ELEMENTOS

LAS PROPIEDADES PERIÓDICAS
Son propiedades que presentan los átomos de un elemento y que varían en la Tabla Periódica siguiendo la periodicidad de los grupos y periodos de ésta. Por la posición de un elemento podemos predecir qué valores tendrán dichas propiedades así como a través de ellas, el comportamiento químico del elemento en cuestión. y como hemos dicho, vamos a encontrar una periodicidad de esas propiedades en la tabla.
-Estructura electrónica
- Radio atómico
- Volumen atómico
- Potencial de ionización- Afinidad electrónica
- Electronegatividad:
- Carácter metálico
- Radio iónico - Radio covalente
- Radio atómico
- Volumen atómico
- Potencial de ionización- Afinidad electrónica
- Electronegatividad:
- Carácter metálico
- Radio iónico - Radio covalente
LAS PROPIEDADES DE LOS ELEMENTOS
ENERGÍA ELÉCTRICA

CORRIENTE ELÉCTRICA

ELECTROMAGNETISMO

La energía eléctrica es una fuente de energía renovable que se obtiene mediante el movimiento de cargas eléctricas (electrones positivos y negativos) que se produce en el interior de materiales conductores (por ejemplo, cables metálicos como el cobre).
El origen de la energía eléctrica está en las centrales de generación, determinadas por la fuente de energía que se utilice. Así, la energía eléctrica puede obtenerse de centrales solares, eólicas, hidroeléctricas, térmicas, nucleares y mediante la biomasa o quema de compuesto de la naturaleza como combustible.
La corriente eléctrica o intensidad eléctrica es el flujo de carga eléctrica por unidad de tiempo que recorre un material.Se debe al movimiento de las cargas (normalmente electrones) en el interior del material. En el Sistema Internacional de Unidades se expresa en (culombios sobre segundo), unidad que se denomina amperio. Una corriente eléctrica, puesto que se trata de un movimiento de cargas, produce un campo magnético, un fenómeno que puede aprovecharse en el electroimán.
ELECTROMAGNETISMO
La naturaleza de las ondas electromagnéticas consiste en la propiedad que tienen el campo eléctrico y magnético de generarse mutuamente cuando cambian en el tiempo.
El plano de oscilación del campo eléctrico (rayas rojas en el diagrama superior) define la dirección de polarización de la onda . Se dice que una fuente de luz produce luz polarizada cuando la radiación emitida viene con el campo eléctrico alineado preferencialmente en una dirección.
- Ejemplos de ondas electromagnéticas son:
• Las señales de radio y televisión
• Ondas de radio provenientes de La Galaxia
• Microondas generadas en los hornos microondas
• Radiación Infrarroja provenientes de cuerpos a temperatura ambiente
• La Luz
• La radiación Ultravioleta proveniente del Sol, de la cual la crema anti solar nos proteje la piel
• Los Rayos X usados para tomar radiografías del cuerpo humano

ENERGÍA NUCLEAR
La energía nuclear es la energía que se obtiene al manipular la estructura interna de los átomos. Se puede obtener mediante la división del núcleo (fisión nuclear) o la unión de dos átomos (fusión nuclear).
Generalmente, esta energía (que se obtiene en forma de calor) se aprovecha para generar energía eléctrica en las centrales nucleares, aunque existen muchas otras aplicaciones de la energía nuclear.
FUSIÓN NUCLEAR
La fusión nuclear es una reacción nuclear en la que dos núcleos de átomos ligeros, en general el hidrógeno y sus isótopos (deuterio y tritio), se unen para formar otro núcleo más pesado. Generalmente esta unión va acompañada con la emisión de partículas (en el caso de núcleos atómicos de deuterio se emite un neutrón). Esta reacción de fusión nuclear libera o absorbe una gran cantidad de energía en forma de rayos gamma y también de nergía cinética de las partículas emitidas. Esta gran cantidad de energía permite a la materia entrar en estado de plasma.
APLICACIONES DE LA ENERGÍA NUCLEAR
Medicina
Uno de cada tres pacientes que acuden a un hospital en un país industrializado, recibe los beneficios de algún tipo de procedimiento de medicina nuclear. Se emplean radio fármacos, técnicas como la radioterapia para el tratamiento de tumores malignos, la tele terapia para el tratamiento ontológico o la biología radiológica que permite esterilizar productos médicos.
AGRICULTURA
La tecnología nuclear resulta de gran utilidad en el control de plagas de insectos, en el máximo aprovechamiento de los recursos hídricos, en la mejora de las variedades de cultivo o en el establecimiento de las condiciones necesarias para optimizar la eficacia de los fertilizantes y el agua.
CONSERVACIÓN DE LOS ALIMENTOS
En cuanto a la alimentación, las técnicas nucleares juegan un papel fundamental en la conservación de alimentos.
DETERMINACIÓN DE LAS CUSAS DE LA CONTAMINACIÓN
La aplicación de isótopos permite determinar las cantidades exactas de las sustancias contaminantes y lugares en que se presentan así como sus causas. Además, el tratamiento con haces de electrones permite reducir las consecuencias medioambientales y sanitarias del empleo a gran escala de combustibles fósiles, y contribuye de manera más efectiva que otras técnicas a resolver problemas como “el efecto invernadero” y la lluvia ácida.








